Наиболее характерными являются следующие физические свойства металлов:
- твердость,
- металлический блеск,
- ковкость,
- пластичность,
- хорошая проводимость электричества и тепла.
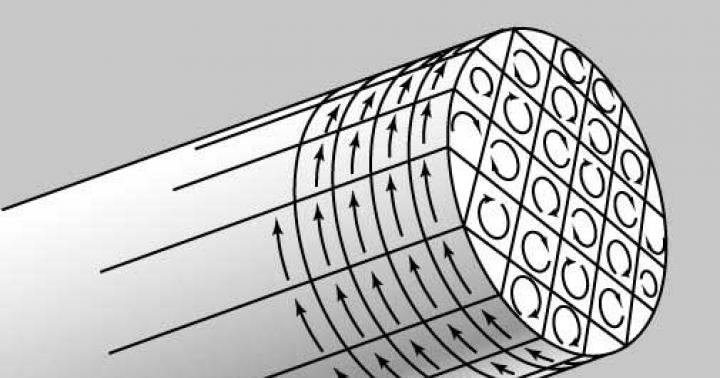
Для всех видов металлов характерна кристаллическая металлическая решетка. В ее узлах располагаются положительно заряженные ионы, между которыми свободно перемещаются электроны. Наличие электронов и объясняет высокую теплопроводность и электропроводность, а также возможность поддаваться механической обработке. Стоит рассмотреть более подробно общие физические свойства металлов.
Основные физические свойства металлов
Температура плавления чистых металлов находится в диапазоне от -39 до 3410°C. У большинства металлов температура плавления очень высока, исключения составляют щелочные металлы. Однако существуют и такие виды металлов, которые можно легко расплавить на обычной газовой плите. К таким металлам относятся, например, свинец или олово. В зависимости от плотности, все металлы делятся на тяжёлые (5/22,5 г/см 3) и лёгкие (0,53/5 г/см 3). Самый легкий из таких металлов - литий (0.53 г/см 3). Практически все металлы обладают хорошей пластичностью. Происходит это из-за смещения слоёв атомов без разрыва между ними связи. Самые пластичные металлы - золото, серебро и медь. Пластичность также зависит и от чистоты металла. Очень чистым металлом считается хром, однако даже при небольшом загрязнении он становится более твердым и хрупким. Характеристика физических свойств металлов включает в себя и такое понятие, как теплопроводность. Она напрямую зависит от подвижности свободных электронов. Так, самым лучшим проводником электричества и тепла является серебро, следом за ним идет натрий. Он находит большое применение в клапанах автомобильных двигателей.
Физические свойства щелочных металлов
К этому виду металлов относятся:
- натрий,
- литий,
- калий,
- рубидий,
- цезий.
Все эти металлы очень пластичные и мягкие. Наибольшую твердость имеет литий, что касается остальных металлов, то они легко режутся ножом и даже могут быть раскатаны в фольгу. Все щелочные металлы в кристаллическом состоянии имеют объемоцентрированную кристаллическую решетку, обладающую металлическим типом химической связи. Это обуславливает высокую электро- и теплопроводность данного вида металлов. Щелочные металлы имеют крайне небольшую плотность. Так самый легкий из них – литий. Его плотность составляет 0,53 г/см 3 . Эти металлы обладают достаточно низкими температурами кипения и плавления. С увеличением порядкового номера металла, его температура плавления понижается. Все щелочные металлы крайне активны. По этой причине хранить их следует в запаянных ампулах, под слоем керосина или вазелинового масла. Все это физические свойства металлов. Химия также играет немаловажную роль в металловедение.
Химические свойства металлов
В химическом отношении металлы характеризуются легкостью отдачи валентных электронов, а также способностью образовывать положительно заряженные ионы. Таким образом, все металлы являются восстановителями в свободном состоянии. Их восстановительная способность неодинакова. Она определяется за счет положения в электрохимическом ряду напряжения металлов. Все металлы размещаются в порядке убывания относительно их восстановительных свойств, а также усиления окислительных свойств ионов. Такой ряд характеризует химическую активность металла исключительно в окислительно-восстановительных реакциях, которые протекают в водной среде. Так, характерными химическими свойствами для металлов являются их восстановление и взаимодействие с водой.
Восстановление неметаллов
Различные реакции с кислородом воздуха и галогенами протекают при разных скоростях и при различных температурах. Например, щелочные металлы легче всего окисляются кислородом воздуха, а также взаимодействуют с простыми веществами. Что касается меди и железа, то они взаимодействуют с простыми веществами при нагревании, а платиновые металлы и золото вообще не окисляются. Многие металлы могут образовывать на поверхности оксидную пленку, она защищает их от последующего окисления:
2К + Сl 2 = 2КСl 2Мg + О 2 = 2МgО
Взаимодействие с водой
С водой способны взаимодействовать щелочные металлы. Данный процесс происходит при обычных условиях с выделением водорода и образованием гидроксидов:
2Аl + 6Н 2 O = 2Аl(ОН) 3 + ЗН 2 2Nа + 2Н 2 О = 2NаОН + Н 2
Простые вещества — металлы Из 109 химических элементов ПСХЭМ 87 образуют в свободном состоянии простые вещества с металлической связью.

 Металлы- это ковкие, пластичные, тягучие вещества, которые имеют металлический блеск, тепло- и электропроводны. Имеют на внешнем уровне от 1 до 3 электронов.
Металлы- это ковкие, пластичные, тягучие вещества, которые имеют металлический блеск, тепло- и электропроводны. Имеют на внешнем уровне от 1 до 3 электронов.
 Физические свойства металлов: Пластичность — это важнейшее свойство металлов изменять форму при ударе, прокатываться в тонкие листы и вытягиваться в проволоку. Пластичные металлы: золото (Au), серебро (Ag), медь (Cu). Хрупкие металлы: висмут (Bi).
Физические свойства металлов: Пластичность — это важнейшее свойство металлов изменять форму при ударе, прокатываться в тонкие листы и вытягиваться в проволоку. Пластичные металлы: золото (Au), серебро (Ag), медь (Cu). Хрупкие металлы: висмут (Bi).
 Знаете ли Вы? . . . что золото самый пластичный металл. Один грамм золота можно вытянуть в проволоку длинной два километра! Чистое золото мнётся почти как пластилин! Au
Знаете ли Вы? . . . что золото самый пластичный металл. Один грамм золота можно вытянуть в проволоку длинной два километра! Чистое золото мнётся почти как пластилин! Au
 Физические свойства металлов: Твердость. Мягкие металлы — натрий (Na), калий (K), индий (In), алюминий (Al), олово (Sn), свинец (Pb). Твердые металлы — хром (Cr), титан (Ti), молибден (Mo).
Физические свойства металлов: Твердость. Мягкие металлы — натрий (Na), калий (K), индий (In), алюминий (Al), олово (Sn), свинец (Pb). Твердые металлы — хром (Cr), титан (Ti), молибден (Mo).
 Знаете ли Вы? . . . что калий самый мягкий металл. Он настолько мягкий, что его можно отрезать ножом! K
Знаете ли Вы? . . . что калий самый мягкий металл. Он настолько мягкий, что его можно отрезать ножом! K
 Знаете ли Вы? . . . что хром самый твердый металл. Им можно поцарапать даже стекло! Cr
Знаете ли Вы? . . . что хром самый твердый металл. Им можно поцарапать даже стекло! Cr
 Физические свойства металлов: Температура плавления металлов колеблется от -39 °C (у ртути) до 3380 °C (у вольфрама) Так, например, температуры плавления: 1) железа 1539 °C 2) алюминий 660 °C 3) хрома 1857 °C 4) титана 1660± 20 °
Физические свойства металлов: Температура плавления металлов колеблется от -39 °C (у ртути) до 3380 °C (у вольфрама) Так, например, температуры плавления: 1) железа 1539 °C 2) алюминий 660 °C 3) хрома 1857 °C 4) титана 1660± 20 °
 Знаете ли Вы? . . . что вольфрам самый тугоплавкий металл! Его температура плавления составляет 3380 °CW
Знаете ли Вы? . . . что вольфрам самый тугоплавкий металл! Его температура плавления составляет 3380 °CW
 Знаете ли Вы? . . . что ртуть единственный жидкий металл при нормальных условиях (н. у). Он становится твердым только при -39 °C Hg
Знаете ли Вы? . . . что ртуть единственный жидкий металл при нормальных условиях (н. у). Он становится твердым только при -39 °C Hg
 Знаете ли Вы? . . . что галлий очень легкоплавкий металл. Температура плавления галлия немного ниже температуры человеческого организма, всего 28, 5 °C, поэтому его можно расплавить зажав в кулак! Ga
Знаете ли Вы? . . . что галлий очень легкоплавкий металл. Температура плавления галлия немного ниже температуры человеческого организма, всего 28, 5 °C, поэтому его можно расплавить зажав в кулак! Ga
 Физические свойства металлов: Плотность металлов колеблется от 0, 534 г/см³(у лития) до 22, 587 г/см³ (у осмия) Так, например, плотность у: 1) железа 7, 9 г/см³ 2) алюминий 2, 7 г/см³ 3) хрома 7, 2 г/см³ 4) титана 4, 54 г/см³
Физические свойства металлов: Плотность металлов колеблется от 0, 534 г/см³(у лития) до 22, 587 г/см³ (у осмия) Так, например, плотность у: 1) железа 7, 9 г/см³ 2) алюминий 2, 7 г/см³ 3) хрома 7, 2 г/см³ 4) титана 4, 54 г/см³
 Знаете ли Вы? . . . что осмий самый тяжелый металл. Его плотность составляет всего 22, 587 г/см³. Один кубический сантиметр осмия весит почти 23 грамма! Os
Знаете ли Вы? . . . что осмий самый тяжелый металл. Его плотность составляет всего 22, 587 г/см³. Один кубический сантиметр осмия весит почти 23 грамма! Os
 Знаете ли Вы? . . . что литий самый легкий металл. Его плотность составляет всего 0, 534 г/см³. Литий плавает на поверхности воды! Li
Знаете ли Вы? . . . что литий самый легкий металл. Его плотность составляет всего 0, 534 г/см³. Литий плавает на поверхности воды! Li
 Физические свойства металлов: Тепло- и электропроводность. Все металлы хорошо проводят тепло и электрический ток. Лучшими проводниками являются серебро, медь, золото, алюминий.
Физические свойства металлов: Тепло- и электропроводность. Все металлы хорошо проводят тепло и электрический ток. Лучшими проводниками являются серебро, медь, золото, алюминий.
 Знаете ли Вы? . . . что серебро самый электропроводный металл. Если пропускать электрический ток через серебряные провода, то сопротивление будет практически равно нулю! Ag
Знаете ли Вы? . . . что серебро самый электропроводный металл. Если пропускать электрический ток через серебряные провода, то сопротивление будет практически равно нулю! Ag
 Посчитайте массовую долю металла в следующих соединениях: оксид свинца (Pb. O); калийная cелитра (KNO 3); медный купорос (Cu. SO 4).
Посчитайте массовую долю металла в следующих соединениях: оксид свинца (Pb. O); калийная cелитра (KNO 3); медный купорос (Cu. SO 4).
Конспект урока
по химии
в 8 классе
на тему
«Простые вещества – металлы»
Тема: Простые вещества – металлы
Цели:
Образовательные:
1. Расширение и углубление знаний учащихся об особенностях строения атомов металлов, расположения металлов в Периодической системе химических элементов Д.И. Менделеева, строения кристаллической металлической решетки и металлической химической связи.
2. Познакомить с общими физическими свойствами металлов.
3. Научить характеризовать и объяснять свойства веществ на основании вида химической связи и типа кристаллической решетки.
Развивающие:
1. Развитие общеучебных умений и навыков (умение сравнивать, обобщать и делать выводы).
2. Развитие познавательной активности, познавательных и интеллектуальных способностей учащихся, умений самостоятельно приобретать знания.
3. Формирование научной картины мира.
Воспитательные:
1. Способствовать развитию интереса к предмету.
2. Воспитание трудолюбия, внимательности.
Оборудование: компьютер, проектор.
Методы работы: рассказ, беседа, структуры сингапурских методов обучения.
Ход урока:
I . Организационный момент.
Приветствие, подготовка учащихся к уроку. Парты расставлены по парам, ученики сидят по 4 человека за столом. Столы пронумерованы.
II . Актуализация знаний.
Сообщение темы и целей урока
Слайд № 1
В Древнем Египте считали все, что металлов – всего 7!
Семь металлов создал свет по числу семи планет
Медь, железо, серебро… дал нам космос на добро.
Злато, олово, свинец… всем им Ртуть – родной отец.
Слайд №2
Ребята, вы прослушали стихотворение, в котором говорится о теме сегодняшнего урока. Сформулируйте тему урока.
Ответ: Металлы
Слайд №3
Правильно, на сегодняшнем уроке мы с вами будем говорить о металлах. Запишите в тетрадях тему урока «Простые вещества – металлы».
2. Актуализация ранее изученных знаний
Обратите внимание на тему урока. Понятия «простые вещества» и «металлы» нам уже знакомы. Давайте вспомним, какие вещества называются простыми?
Ответ: Вещества, состоящие из атомов одного вида, называются простыми веществами.
А что вы уже знаете о металлах?
Ответ: Строение металлов, расположение в Периодической системе элементов металлов, металлическую химическую связь.
Заполните колонку «ДО» в таблице, которая перед вами (Сингапурская структура «Эй-ар-гайд»). (Отводится 2 минуты) (Приложение 1)
Теперь, положите листочки на край стола, вернемся к этому заданию в конце урока.
Вспомним расположение металлов в ПСХЭ.
Если провести диагональ от элемента бора В (порядковый номер 5) до элемента астата At (порядковый номер 85), то слева внизу под этой диагональю в Периодической системе все элементы являются металлами, кроме этого металлами являются все элементы побочных подгрупп. Справа вверху над диагональю находятся элементы неметаллы (исключая металлы побочных подгрупп).
Каких элементов в Периодической таблице Д.И. Менделеева больше?
Ответ: В Периодической таблице Д.И.Менделеева больше металлов .
Зарисуйте в тетради схему с доски. (Приложение 2)
Из 110 элементов Таблицы Д.И.Менделеева 88 металлы и лишь 22 неметаллы.
Слева направо по периоду металлические свойства и R атома уменьшаются.
Сверху вниз по группе металлические свойства химических элементов и R атома увеличиваются.
- Сколько всего электронов у металлов на внешнем энергетическом уровне?
Ответ: От 1 до 3 электронов на внешнем энергетическом уровне.
- Зная, что металлы имеют сравнительно большие радиусы атомов и небольшое количество электронов на внешнем энергетическом уровне, ответьте, к чему стремятся атомы металлов?
Ответ: Атомы металлов стремятся к отдать электроны с внешнего энергетического уровня.
Во что превратятся атомы металлов, отдавшие электроны?
Ответ: Атомы металлов превращаются в положительно заряженные ионы.
Слайд №4
Простые вещества, которые образуют элементы – металлы, при обычных условиях, являются твердыми кристаллическими веществами, кроме ртути, свинца.
Вспомним строение кристаллической решетки металлов.
Ответ: В узлах металлической кристаллической решетки находятся положительные ионы и атомы металлов (атом-ионы), а между ними – свободные электроны. Эти электроны свободно перемещаться. Свободные электроны имеют отрицательный заряд и притягивают положительно заряженные ионы металлов. Поэтому кристаллическая решетка металлов является устойчивой.
- Правильно, в металле постоянно существуют атомы, ионы и свободные электроны. Составьте на доске схемы металлической химической связи для Na , Mg , Al .
Вызываются по очереди ученики к доске, а все остальные выполняют в тетрадях.
Ответы:
Li 0 -1 ē Li 1+
Ca 0 -2 ē Ca 2+
Al 0 -3 ē Al 3+
Проверьте свои записи.
Вспомните, как называется связь между положительными ионами металлов и свободными электронами в кристаллической решетке металлов?
Ответ: Металлическая связь.
Свободные электроны внутри металлической кристаллической решетки могут переносить теплоту и электричество, отражать световые волны, поэтому они являются причиной главных физических свойств металлов – высокой электро- и теплопроводности.
Слайд №5
III . Изучение нового материала.
Начинаем изучать «Физические свойства металлов».
Сейчас мы будем изучать физические свойства металлов, которые вы должны перечислить в тетради. При этом запишем сведения с экрана.
1. Твердость – все металлы при обычных условиях твердые вещества, кроме ртути. (Просмотр видео «Ртуть» )
По твердости металлы делятся на мягкие и твердые. Самый твердый из металлов – хром, который может царапать стекло. Самые мягкие – щелочные металлы и свинец (Демонстрация видео «Щелочные металлы – Литий, натрий, калий») . Щелочные металлы хранят в особых условиях: литий в вазелине из-за своей низкой плотности, натрий в керосине, керосин в стеленной баночке, баночка в асбестовой крошке, асбест в жестяной баночке, жестяная баночка в сейфе.
Слайд №6
2. Пластичность, ковкость – это свойство металлов изменять свою форму при ударе. Прокатываться в тонкие листы и вытягиваться в проволоку. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи и поэтому металл характеризуется высокой пластичностью.
Самым пластичным из драгоценных металлов является золото. Один его грамм можно вытянуть в проволоку длиной 2км. Демонстрация учащимся алюминиевую фольгу.
Слайд №7
3. Металлический блеск – все металлы обладают металлическим блеском. Электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Самые блестящие металлы – это ртуть и серебро. Из ртути изготавливали в средние века знаменитые «венецианские зеркала», современные зеркала изготавливают из серебра.
Слайд №8
4. Металлы звенят – это свойство используется для изготовления колоколов, музыкальных инструментов и т.д. самые звонкие металлы – это золото, серебро и медь.
Демонстрация звона золотого обручального кольца, подвешенного на женском волосе. При ударе по нему деревянной палочкой (карандашом) слышен очень долгий высокий и чистый звук.
Слайд №9
5. Тепло- и электропроводность – металлы, характеризующиеся высокой электрической проводимостью, обладают и высокой теплопроводностью. Лучшие проводники серебро, медь, золото, железо, алюминий.
Если самый лучший проводник – серебро, то почему электрические провода из него не делают?
Ответ: Высокая стоимость этого металла.
Худшей тепло-, электропроводностью обладают ртуть, свинец вольфрам.
Слайд №10
6. Температура плавления металлов изменяется в широких пределах. Самый легкоплавкий металл – ртуть (t 0 пл. = -38.9 0 С), самый тугоплавкий – Вольфрам (t 0 пл. = 3380 0 С).
Слайд №11
7. Плотность металлов тожеизменяется в широких пределах. Металл с наименьшей плотностью – литий 0,53*10 3 кг/м 3. Металл с наибольшей плотностью осмий 22,48*10 3 кг/м 3 .
Слайд №12
8. Аллотропия - способность атомов одного ХЭ образовывать несколько простых веществ – модификации.
Рассказ учителя про аллотропные модификации олова.
IV . Физминутка
Слайд№ 13-24
А теперь немножко отдохнем. Внимательно смотрите на экран, на нем будут появляться названия химических элементов. Если на экране – металл, вы должны встать, если нет – продолжаем сидеть (Сингапурская структура «Тейк оф тач даун»). Внимание на экран!
А теперь вернемся снова к таблицам, которые мы заполняли в начале урока. Только теперь заполните колонку «После». (Дается время – 2мин)
Изменилось ли ваше мнение?
Ответ:
Зачитайте мне ваши результаты, стол №…. участник №… (так учитель спрашивает у нескольких учеников)
В конце проверим, что вы усвоили на сегодняшнем уроке. Для этого возьмите лист А4, которые у вас на столах. Сложите в 4, потом сложите уголок и раскройте лист. (Сингапурская структура «Модель Фрейера») (Приложение 3)
(Дается 10 минут)
Теперь за каждым столом по очереди зачитайте ваши ответы («Сингл раунд робин»). (На каждого ученика по 30 секунд)
Стол №… , участник №…, зачитайте ваши ответы (спрашивается у нескольких учеников)
VIII . Домашнее задание:
Слайд №25
Приложение 1
Эй-ар-гайд
ДО
Утверждения
ПОСЛЕ
Все металлы по агрегатному состоянию твердые
Все металлы тугоплавкие
Металлы хорошо проводят электрический ток
Все металлы имеют высокую плотность
Металлы имеют блеск

Металлы


Примеры
Противоположные примеры
Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп, выделены синим цветом), а справа вверху – элементы-неметаллы (выделены желтым цветом). Элементы, расположенные вблизи диагонали – полуметаллы или металлоиды (B, Si, Ge, Sb и др.), обладают двойственным характером (выделены розовым цветом).
Как видно из рисунка, подавляющее большинство элементов являются металлами.
По своей химической природе металлы – это химические элементы, атомы которых отдают электроны с внешнего или предвнешнего энергетического уровней, образуя при этом положительно заряженные ионы.
Практически все металлы имеют сравнительно большие радиусы и малое число электронов (от 1 до 3) на внешнем энергетическом уровне. Для металлов характерны низкие значения электроотрицательности и восстановительные свойства.
Наиболее типичные металлы расположены в начале периодов (начиная со второго), далее слева направо металлические свойства ослабевают. В группе сверху вниз металлические свойства усиливаются, т.к увеличивается радиус атомов (за счет увеличения числа энергетических уровней). Это приводит к уменьшению электроотрицательности (способности притягивать электроны) элементов и усилению восстановительных свойств (способность отдавать электроны другим атомам в химических реакциях).
Типичными металлами являются s-элементы (элементы IА-группы от Li до Fr. элементы ПА-группы от Мg до Rа). Общая электронная формула их атомов ns 1-2 . Для них характерны степени окисления + I и +II соответственно.
Небольшое число электронов (1-2) на внешнем энергетическом уровне атомов типичных металлов предполагает легкую потерю этих электронов и проявление сильных восстановительных свойств, что отражают низкие значения электроотрицательности. Отсюда вытекает ограниченность химических свойств и способов получения типичных металлов.
Характерной особенностью типичных металлов является стремление их атомов образовывать катионы и ионные химические связи с атомами неметаллов. Соединения типичных металлов с неметаллами — это ионные кристаллы «катион металлаанион неметалла», например К + Вг — , Сa 2+ О 2-. Катионы типичных металлов входят также в состав соединений со сложными анионами — гидроксидов и солей, например Мg 2+ (OН —) 2 , (Li +)2СO 3 2-.
Металлы А-групп, образующие диагональ амфотерности в Периодической системе Ве-Аl-Gе-Sb-Ро, а также примыкающие к ним металлы (Gа, In, Тl, Sn, Рb, Вi) не проявляют типично металлических свойств. Общая электронная формула их атомов ns 2 np 0-4 предполагает большее разнообразие степеней окисления, большую способность удерживать собственные электроны, постепенное понижение их восстановительной способности и появление окислительной способности, особенно в высоких степенях окисления (характерные примеры — соединения Тl III , Рb IV , Вi v). Подобное химическое поведение характерно и для большинства (d-элементов, т. е. элементов Б-групп Периодической системы (типичные примеры — амфотерные элементы Сr и Zn).
Это проявление двойственности (амфотерности) свойств, одновременно металлических (основных) и неметаллических, обусловлено характером химической связи. В твердом состоянии соединения нетипичных металлов с неметаллами содержат преимущественно ковалентные связи (но менее прочные, чем связи между неметаллами). В растворе эти связи легко разрываются, а соединения диссоциируют на ионы (полностью или частично). Например, металл галлий состоит из молекул Ga 2 , в твердом состоянии хлориды алюминия и ртути (II) АlСl 3 и НgСl 2 содержат сильно ковалентные связи, но в растворе АlСl 3 диссоциирует почти полностью, а НgСl 2 — в очень малой степени (да и то на ионы НgСl + и Сl —).
Общие физические свойства металлов
Благодаря наличию свободных электронов («электронного газа») в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность — способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность . Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий — литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются «легкими металлами».
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me 0 – nē → Me n +
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
I. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O 2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl 2 – t° → NiCl 2
4) С азотом:
3Ca + N 2 – t° → Ca 3 N 2
5) С фосфором:
3Ca + 2P – t° → Ca 3 P 2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H 2 → 2LiH
Ca + H 2 → CaH 2
II. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl → MgCl 2 + H 2
2Al+ 6HCl → 2AlCl 3 + 3H 2
6Na + 2H 3 PO 4 → 2Na 3 PO 4 + 3H 2
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
Zn + 2H 2 SO 4(К) → ZnSO 4 + SO 2 + 2H 2 O
4Zn + 5H 2 SO 4(К) → 4ZnSO 4 + H 2 S + 4H 2 O
3Zn + 4H 2 SO 4(К) → 3ZnSO 4 + S + 4H 2 O
2H 2 SO 4(к) + Сu → Сu SO 4 + SO 2 + 2H 2 O
10HNO 3 + 4Mg → 4Mg(NO 3) 2 + NH 4 NO 3 + 3H 2 O
4HNO 3 (к) + Сu → Сu (NO 3) 2 + 2NO 2 + 2H 2 O
III. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2Na + 2H 2 O → 2NaOH + H 2
Ca+ 2H 2 O → Ca(OH) 2 + H 2
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn + H 2 O – t° → ZnO + H 2
3) Неактивные (Au, Ag, Pt) — не реагируют.
IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:
Cu + HgCl 2 → Hg+ CuCl 2
Fe+ CuSO 4 → Cu+ FeSO 4

В промышленности часто используют не чистые металлы, а их смеси - сплавы , в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь ) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем — дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) — это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой , в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина ), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией . Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте — металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа + , Са 2+ ,А1 3+ ,Fе 2+ и Fе 3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg — только серной (концентрированной) и азотной кислотами, а Рt и Аи — «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их , т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО 2 и SО 2 ; создается кислотная среда, и катионы Н + вытесняются активными металлами в виде водорода Н 2 (водородная коррозия ).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия). Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении ; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь ), имеют высокую коррозионную стойкость.
электрометаллургия , т. е. получение металлов электролизом расплавов (для наиболее активных металлов) или растворов солей;
пирометаллургия , т. е. восстановление металлов из руд при высокой температуре (например, получение железа в доменном процессе);
гидрометаллургия , т. е. выделение металлов из растворов их солей более активными металлами (например, получение меди из раствора СuSO 4 действием цинка, железа или алюминия).
В природе иногда встречаются самородные металлы (характерные примеры — Аg, Аu, Рt, Нg), но чаще металлы находятся в виде соединений (металлические руды ). По распространенности в земной коре металлы различны: от наиболее распространенных — Аl, Nа, Са, Fе, Мg, К, Тi) до самых редких — Вi, In, Аg, Аu, Рt, Rе.
Какие химические элементы являются металлами и какие являются неметаллами?
- МЕТАЛЛЫ это вещества, обладающие высокой электропроводностью и теплопроводностью, ковкостью, пластичностью и металлическим блеском. Эти характерные свойства металла обусловлены наличием свободно перемещающихся электронов в его кристаллической решетке. Из известных в настоящее время 107 химических элементов 85 относятся к металлам.
Деление всех химических элементов периодической системы Д. И. Менделеева на металлы и неметаллы является условным. Если в периодической таблице провести диагональ через бор и астат, то в главных подгруппах, расположенных справа от диагонали, будут неметаллы, а в главных подгруппах слева от диагонали, побочных подгруппах и в восьмой группе (кроме инертных газов) металлы. Причем элементы рядом с разделительной линией являются так называемыми металлоидами, т. е. веществами с промежуточными свойствами (металлов и неметаллов) . К ним относятся: бор В, кремний Si, германий Gе, мышьяк Аs, сурьма Sb, теллур Те, полоний Ро.
В соответствии с местом, занимаемым в периодической системе, различают переходные (элементы побочных подгрупп) и непереходные металлы (элементы главных подгрупп) . Металлы главных подгрупп характеризуются тем, что в их атомах происходит последовательное заполнение электронных s- и р-подуровней. В атомах металлов побочных подгрупп происходит достраивание d- и f-подуровней.
Неметаллы - Это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов.Из известных химических элементов только 22 являются неметаллами. Если провести условную диагональ в переодической системе от берилия к астату, неметаллы окажутся над ней т. е. они находятся в правом верхнем углу.
Атомы неметаллов (по сравнению с атомами металлов) содержат большее число электронов на внешнем энергетическом уровне, по этому простые вещества - неметаллы обладают, как правило, окислительно - восстановительной деятельностью (кроме фтора и кислорода, которые являются окислителями)
Неметаллы различны по своему агрегатному состоянию. Многие из них газы (кислород, азот, гелий, водород, неон, ксенон, криптон и т. д.). Твердые вещества (фосфор, фтор, йод, бор и т. д.). Бром является жидкостью.
Для неметаллов характерно явление аллотропии. многие из них существуют в виде аллотропных видоизменений, например - фосфор, углерод, кислород, сера и т. д.
Неметаллы имеют различные типы кристаллической решетки - атомную (бор, кремний, углерод в виде алмаза) и молекулярную (йод, белый фосфор, сера кристаллическая)
Физические свойства неметаллов зависят от типа решетки. Вещества с молекулярной решеткой - летучие, легкоплавкие, непрочные, с незначительной растворимостью в воде.
- проще говоря, металлы, это те элементы, которые на внешнем электронном уровне имеют 1-3 электрона, т. е. при взаимодействии с другими элементами, они легко отдают эти электроны. Это 1, 2, 3 группа (гл. подг) перидической системы
А неметаллы, это те элементы, которые имеют почти завершенный электронный уровень, которым не хватает до завершения 1-3 электрона. Это 5,6,7 группа - Кароче, там есть такая таблица металлов (такая полосочка, начинаеться Литем (кажись) а заканчиваеться чем-то тяжлым) .
Основным признаком что эллемент - металл, являеться слабая связь электронов последнего уровня с ядром, они (металлы) могут эти электроны отдавать.С этим связна причина их электропроводности.